Tôi là một dung môi và thuốc thử tiện dụng, nhưng hãy xử lý cẩn thận!
Tôi là phân tử nào?
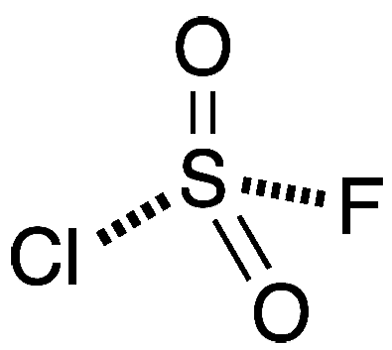
Thông tin nhanh về Sulfuryl chloride fluoride
| Số đăng ký CAS No. | 13637-84-8 |
| Danh pháp SciFinder | Sulfuryl chloride fluoride |
| Công thức thực nghiệm | ClFO2S |
| Khối lượng phân tử | 118,52 g / mol |
| Xuất hiện | Khí không màu hoặc chất lỏng không màu đến vàng nhạt |
| Độ nóng chảy | 7.1 ºC |
| Khả năng hòa tan trong nước | Phản ứng |
Sulfuryl chloride fluoride (SO2ClF) là một axit Lewis mạnh và là một dung môi và thuốc thử hữu ích. Như được trình bày trong bảng thông tin nguy hiểm, nó phải được xử lý cẩn thận. Điểm sôi của nó nằm trong khoảng cho phép sử dụng dưới dạng khí hoặc chất lỏng.
Vào những năm 1930, Harold Simmons Booth* và Carl V. Herrmann tại Đại học Western Reserve (Cleveland; sau này là Đại học Case Western Reserve) đã thực hiện công trình tiên phong về SO2ClF. Họ tổng hợp nó thông qua phản ứng của sulfuryl chloride (SO2Cl2) và antimon trifluoride (SbF3) với sự có mặt của antimon pentachlorua (SbCl5). Họ cũng đo một số tính chất của SO2ClF, bao gồm điểm sôi, điểm nóng chảy, tỉ trọng chất lỏng, áp suất hơi từ –89 đến +9 ºC, nhiệt hóa hơi và sức căng bề mặt.
Nhưng nhà vô địch thực sự của SO2ClF là nhà Nobel hóa học năm 1994 George A. Olah. Năm 1967, cũng tại Case Western, Olah và Joachim Lukas đã sử dụng hệ dung môi SO2ClF – fluorosulfonic acid (FSO3H) –antimony pentafluoride (SbF5) để tạo ra các ion alkylcarbonium ổn định (hiện nay được gọi là carbocation) —từ những chất đơn giản như Me3C+ và Me2EtC+ thông qua các cation chứa tối đa chín nguyên tử carbon. Hỗn hợp axit giống như hỗn hợp mà họ sử dụng được gọi là siêu axit.
Năm 1976, Olah, Mark R. Bruce và John Welch đã phát triển một phương pháp tổng hợp cải tiến SO2ClF bằng cách thêm SO2Cl2 vào pyridinium poly(hydrogen fluoride) trong điều kiện êm dịu. Đến đầu những năm 1980, hiện nay tại Đại học Nam California (Los Angeles), Olah và các đồng nghiệp đã phát triển SO2ClF như một loại thuốc thử đa năng. Một số ứng dụng SO2ClF bao gồm:
- Một chất khử nước để chuyển đổi aldoximes thành nitril;
- kết hợp với trietylamin, một thuốc thử để tạo amiade từ axit cacboxylic và amin bậc một và este từ axit cacboxylic và rượu;
- kết hợp với lưu huỳnh trioxide, một chất ôxy hóa để chuyển hóa phốt phát và arsine bậc ba thành các oxit tương ứng của chúng; và
- kết hợp với SO2Cl2 , một thuốc thử để chuyển ete enol silyl thành α-chloro xeton.
Cuối cùng, vào năm 1992, V. Prakash Reddy, Donald R. Bellew, và GK Surya Prakash* tại USC đã báo cáo một sự tổng hợp hữu ích khác của SO2ClF, từ SO2Cl2 và amoni hoặc kali fluoride với sự có mặt của axit trifluoroacetic. Surya Prakash là học trò của Olah và là người kế nhiệm ông với tư cách là giám đốc Viện nghiên cứu hydrocarbon Loker của USC, địa điểm của phần lớn nghiên cứu carbocation của Olah.
Thông tin về mối nguy hiểm của sulfuryl chloride fluoride
| Nhóm sự cố** | Tuyên bố nguy hiểm | |
|---|---|---|
| Khí chịu áp suất, khí hóa lỏng | H280 — Chứa khí dưới áp suất; có thể nổ nếu bị đốt nóng | |
| Độc tính cấp, qua đường miệng, loại 3 | H301 — Độc nếu nuốt phải | |
| Độc tính cấp tính, qua da, loại 3 | H311 — Độc khi tiếp xúc với da | |
| Ăn mòn / kích ứng da, loại 1B | H314 — Gây bỏng da nghiêm trọng và tổn thương mắt | |
| Tổn thương mắt nghiêm trọng / kích ứng mắt, loại 1 | H318 — Gây tổn thương mắt nghiêm trọng | |
| Độc tính cấp, qua đường hô hấp, loại 3 | H331 — Độc nếu hít phải | |
| Độc tính cơ quan đích cụ thể, phơi nhiễm một lần, kích ứng đường hô hấp, loại 3 | H335 — Có thể gây kích ứng đường hô hấp | |
| Ngạt thở đơn giản, loại 1 | H380 — Có thể thay thế oxy và gây ngạt thở nhanh chóng |
* Tổng hợp nhiều phiếu dữ liệu an toàn.
** Hệ thống phân loại và ghi nhãn hóa chất được hài hòa trên toàn cầu.
Giải thích từ tượng hình.
Tham khảo ACS.
