Vào ngày này (ngày 9 tháng 1) năm 1868, nhà hóa học người Đan Mạch Søren Sørensen đã ra đời. Ông nổi tiếng với việc phát triển thang đo pH, thứ mà chúng ta có thể đã gặp phải, để đo độ axit hoặc độ kiềm của các dung dịch. Bài viết này cung cấp một cái nhìn tổng quan ngắn gọn về thang đo pH và ý nghĩa của nó.
Đôi nét
Thang đo pH là thứ mà tất cả chúng ta đều quen thuộc; hầu hết mọi người sẽ nhớ nó từ các bài học hóa học ở trường. Đó là thang đo được sử dụng để xếp hạng mức độ mạnh của dung dịch axit (hoặc kiềm). Các màu liên quan đến mỗi số tương ứng với màu mà chất chỉ thị phổ biến chuyển thành các dung dịch có độ pH cụ thể đó. Tuy nhiên, một tỷ lệ khá lớn mọi người có thể không biết hóa học đằng sau thang đo pH – chính xác thì những con số này đến từ đâu?
Sørensen đang làm việc tại Phòng thí nghiệm Nghiên cứu Carlsberg — vâng, đó chính là bia Carlsberg — khi ông nghĩ ra thang đo pH vào năm 1909. Thang đo này là kết quả của công trình nghiên cứu của ông về protein, trong đó ông nhận thấy rằng nồng độ của các ion hydro có tác động đặc biệt quan trọng. Thang đo pH đưa ra một cách đơn giản để biểu thị nồng độ ion hydro và đã trở thành một yếu tố chính của môn hóa học ở trường học.
Hóa học đằng sau
Các manh mối thực sự được ẩn một phần trong tên của quy mô. ‘H’ trong pH là viết tắt của nguyên tố, hydro. Ở mức độ đơn giản, thang đo pH có thể được coi là thứ hạng của lượng ion hydro trong dung dịch: càng nhiều ion hydro, chỉ số pH càng thấp. ‘P’ trong pH, ít nhất đối với các nhà hóa học, là viết tắt của phép toán ‘-log 10‘. Khi đó, pH đơn giản bằng -log10 [H+], trong đó [H+] là nồng độ ion hydro trong một dung dịch cụ thể. (Lưu ý rằng, nói đúng ra, chúng ta thường sử dụng H3O+ để biểu thị các ion hydro, vì đây là dạng chúng có trong dung dịch. Tuy nhiên, để đơn giản, chúng ta sẽ tiếp tục sử dụng H+ở đây).
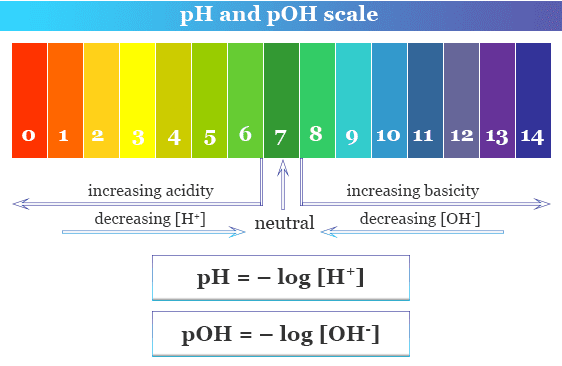
Nhìn vào hình minh họa trên, bạn có thể thấy rằng việc tăng độ pH của một điểm thực sự liên quan đến việc giảm gấp 10 lần nồng độ của các ion hydro trong dung dịch. Thang đo được gọi là thang logarit. Tại sao chúng ta lại bận tâm với thao tác toán học này ngay từ đầu? Chà, rõ ràng là dễ dàng hơn rất nhiều để nêu một con số khi đề cập đến độ axit (hoặc độ kiềm) của dung dịch hơn là trích dẫn nồng độ ion hydro nhiều con số. Độ pH của vết trên 7 biểu thị dung dịch trung tính (không có tính axit hoặc kiềm). Bất kỳ độ pH nào dưới 7 đều có tính axit, trong khi bất kỳ độ pH nào trên 7 được gọi là có tính kiềm.
Các phân tử nước có công thức hóa học là H2O. Tuy nhiên, các phân tử này có khả năng phân tách một chút trong dung dịch, thành các ion H+ và OH– (hydroxit). Trong dung dịch trung tính, nồng độ của hai ion này bằng nhau. Tuy nhiên, việc bổ sung axit hoặc kiềm có thể khiến chúng thay đổi. Axit là nguồn cung cấp các ion hydro và việc thêm chúng vào nước sẽ làm tăng nồng độ của các ion hydro trong dung dịch, làm giảm nồng độ của các ion hydroxit. Đối với kiềm, điều ngược lại là đúng: chúng làm giảm nồng độ của các ion hydro, trong khi tăng nồng độ của các ion hydroxit.
Một điều mà nhiều người không nhận ra là độ pH phụ thuộc vào nhiệt độ. Nói một cách chính xác, nước tinh khiết chỉ có độ pH là 7 ở ‘nhiệt độ phòng’ (25˚C). Trên và dưới nhiệt độ này, nó có thể thay đổi: ví dụ, ở 100˚C, độ pH của nước tinh khiết là 6,14, trong khi ở 0˚C, nó là 7,47. Điều này không có nghĩa là nước tinh khiết trở nên có tính axit hoặc kiềm, nhưng ở những nhiệt độ này, những con số pH cụ thể đó đại diện cho điểm trung tính. Ngoài ra, cũng cần chỉ ra rằng thang đo pH không bị giới hạn trong phạm vi 0-14 thông thường được hiển thị ở đây – một số axit và kiềm mạnh có thể nằm ngoài phạm vi này, thành giá trị pH âm hoặc giá trị cao hơn 14.
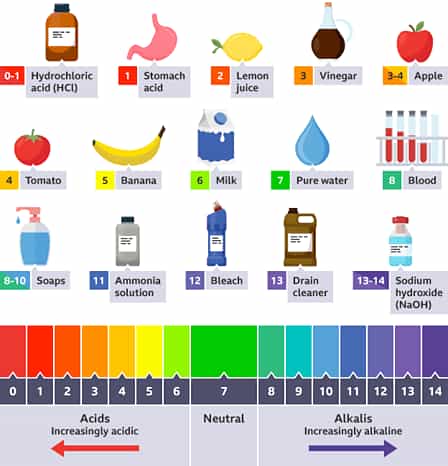
Một quan niệm sai lầm phổ biến khác về độ pH liên quan đến cơ thể con người. Các chế độ ăn kiêng như chế độ ăn kiềm cho rằng có thể ảnh hưởng đến giá trị pH của cơ thể bạn bằng cách thay đổi chế độ ăn uống của bạn để bao gồm các thực phẩm ‘kiềm hóa’ làm cho độ pH của cơ thể bạn trở nên kiềm hơn. Mặc dù những gì thực sự được đề xuất, một chế độ ăn nhiều trái cây và rau quả chắc chắn không có nghĩa là không tốt cho sức khỏe, nhưng những gì bạn ăn không thể thay đổi độ pH của cơ thể. Tôi sẽ không đi vào chi tiết quá nhiều, nhưng cũng đáng để nhắc lại một số điểm chính.
Độ pH của dạ dày có thể thay đổi, từ 1,5 đến 3,5 trên thang đo pH. Tuy nhiên, điều này không ảnh hưởng đến độ pH của cơ thể chúng ta, hay cụ thể hơn là máu của chúng ta. Máu người có giá trị pH luôn hơi kiềm, trong khoảng 7,35-7,45. Nếu chúng ta có thể cố ý thay đổi độ pH của máu bên ngoài phạm vi nhỏ này, chúng ta thực sự có thể gây hại cho chính mình; ngay cả khi thay đổi độ pH 0,5 theo bất kỳ cách nào cũng có thể dẫn đến tổn thương tế bào không thể phục hồi. May mắn thay, thực phẩm chúng ta ăn gần như không ảnh hưởng đến độ pH của máu.
Những gì chúng ta ăn có thể ảnh hưởng đến độ pH của nước tiểu. Độ pH của nước tiểu có giá trị trung bình khoảng 6, nhưng có thể dao động trong khoảng từ 4,5 đến 8. Tuy nhiên, mặc dù bạn có thể có ảnh hưởng nhỏ nhất đến độ pH trong nước tiểu bằng chế độ ăn uống của mình, nhưng nó không liên quan đến độ pH trong máu của bạn; điều này vẫn nằm trong phạm vi đã nêu trước đó, bất kể có bất kỳ thay đổi nào về độ pH trong nước tiểu.
Tiếp tục, và trong khi chúng ta đang nói về axit, điều đáng nói là độ mạnh của axit. Nói một cách chính xác, thật khó để đặt các hợp chất hóa học cụ thể tại các điểm cụ thể trên thang pH, vì vị trí của chúng thay đổi tùy thuộc vào nồng độ. Nồng độ là thước đo lượng chất được hòa tan trong dung dịch. Nếu chúng ta có nhiều axit hòa tan trong một lượng nước tương đối nhỏ, chúng ta sẽ nói rằng chúng ta có dung dịch có nồng độ cao. Tương tự, nếu chúng ta có rất ít axit hòa tan trong nhiều nước, chúng ta sẽ có dung dịch có nồng độ thấp.
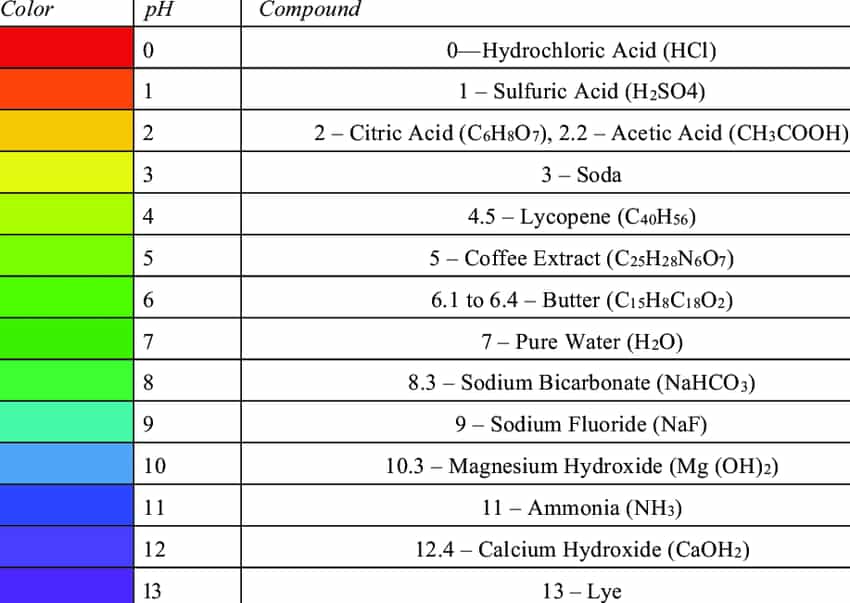
Vì nồng độ của các dung dịch có thể dễ dàng thay đổi nên các dung dịch có nồng độ khác nhau của cùng một loại axit có thể có các giá trị pH khác nhau. Tuy nhiên, một số axit mạnh hơn những axit khác. Axit clohydric, cùng loại axit có trong axit dạ dày, là một axit mạnh vì nó có thể dễ dàng phân tách thành các ion thành phần của nó.
Mặt khác, axit axetic, axit có trong giấm, là một axit tương đối yếu – nó không dễ dàng phân tách thành các ion thành phần của nó. Một ví dụ khác về axit yếu là axit flohydric; trái ngược với những gì mà một chương trình truyền hình có chủ đề hóa học phổ biến nào đó khiến bạn tin tưởng, nó thực sự là một loại axit khá yếu, chắc chắn không thể hòa tan một cơ thể. Đó là một hợp chất khó chịu vì những lý do khác nhau. Chúng ta có thể xếp hạng axit theo độ mạnh của chúng (hoặc mức độ dễ dàng phân tách thành các ion thành phần của chúng), nhưng đó là chủ đề của một bài đăng khác!
Bài viết đến đây là hết rồi. Hi vọng sẽ giúp ích cho các bạn phần nào trong tương lai. Lần sau nếu có ai hỏi về chủ đề này thì hãy nhớ về hóa học đằng sau chúng nhé!
Tham khảo Compound Interest.
