Mọi vật chất đều được tạo thành từ các nguyên tử. Đây là điều mà bây giờ chúng ta hầu như đã biết, và là một trong những điều bạn học ngay từ đầu các lớp hóa học trung học phổ thông hoặc trung học cơ sở. Mặc dù vậy, những ý tưởng của chúng ta về nguyên tử là gì gần đây đáng ngạc nhiên: ít nhất là một trăm năm trước, các nhà khoa học vẫn đang tranh luận xem chính xác nguyên tử trông như thế nào.
Bài viết này xem xét các mô hình chính được đề xuất cho nguyên tử và chúng đã thay đổi như thế nào theo thời gian. Bạn hãy giành ít thời gian để theo dõi nhé!
Những bước đầu tiên
Mặc dù nội dung của chúng ta bắt đầu từ những năm 1800, nhưng ý tưởng về nguyên tử đã có từ rất lâu trước đó. Trên thực tế, chúng ta phải quay trở lại Hy Lạp cổ đại để tìm ra nguồn gốc của nó. Từ ‘nguyên tử’ thực sự xuất phát từ tiếng Hy Lạp cổ đại và tạm dịch là ‘không thể phân chia được’.
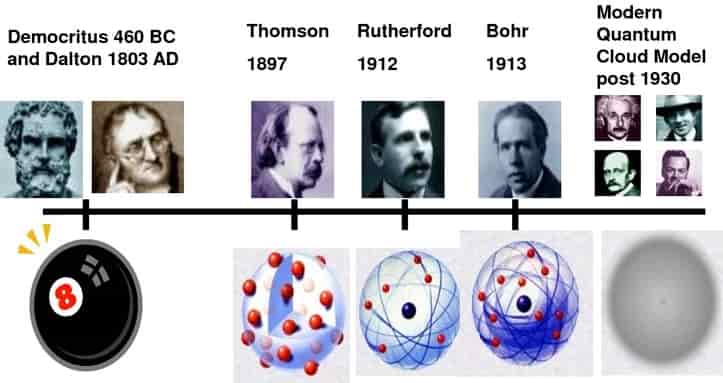
Lý thuyết Hy Lạp cổ đại đã được ghi nhận cho một số học giả khác nhau, nhưng thường được quy cho Democritus (460–370 TCN) và người cố vấn của ông Leucippus. Mặc dù những ý tưởng của họ về nguyên tử còn thô sơ so với những khái niệm của chúng ta ngày nay, nhưng họ đã vạch ra ý tưởng rằng mọi thứ đều được cấu tạo từ nguyên tử, những hình cầu vô hình và không thể phân chia được của vật chất có vô số loại và số lượng.
Các học giả này tưởng tượng các nguyên tử có hình dạng khác nhau tùy thuộc vào loại nguyên tử. Họ hình dung các nguyên tử sắt có những cái móc khóa chúng lại với nhau, giải thích tại sao sắt là chất rắn ở nhiệt độ phòng. Các nguyên tử nước mượt và trơn, giải thích tại sao nước là chất lỏng ở nhiệt độ phòng và có thể đổ được. Mặc dù bây giờ chúng ta biết rằng không phải như vậy, nhưng ý tưởng của họ đã đặt nền móng cho các mô hình nguyên tử trong tương lai.
Tuy nhiên, đã phải đợi một thời gian dài trước khi những nền móng này được xây dựng. Cho đến năm 1803, nhà hóa học người Anh John Dalton mới bắt đầu phát triển một định nghĩa khoa học hơn về nguyên tử. Ông đã dựa trên ý tưởng của người Hy Lạp cổ đại trong việc mô tả các nguyên tử như những khối cầu nhỏ, cứng không thể phân chia được và rằng các nguyên tử của một nguyên tố nhất định giống hệt nhau.
Điểm thứ hai vẫn còn đúng, với ngoại lệ đáng chú ý là các đồng vị của các nguyên tố khác nhau, khác nhau về số lượng neutron của chúng. Tuy nhiên, vì neutron sẽ không được phát hiện cho đến năm 1932, nên chúng ta có thể tha thứ cho sự vô ý này của Dalton. Ông cũng đưa ra lý thuyết về cách các nguyên tử kết hợp để tạo ra hợp chất, và cũng đưa ra bộ ký hiệu hóa học đầu tiên cho các nguyên tố đã biết.
Việc phác thảo lý thuyết nguyên tử của Dalton là một bước khởi đầu, nhưng nó vẫn chưa thực sự cho chúng ta biết nhiều về bản chất của chính nguyên tử. Tiếp theo là một giai đoạn tạm lắng khác, ngắn hơn, nơi mà kiến thức của chúng ta về nguyên tử không tiến bộ nhiều như vậy.
Đã có một số nỗ lực để xác định các nguyên tử có thể trông như thế nào, chẳng hạn như gợi ý của Lord Kelvin cho rằng chúng có thể có cấu trúc giống như xoáy nước (vortex-like), nhưng phải đến ngay sau khi bước sang thế kỷ 20, tiến trình làm sáng tỏ cấu trúc nguyên tử mới thực sự bắt đầu nhặt lên.
Những bước đột phá
Bước đột phá đầu tiên đến vào cuối những năm 1800 khi nhà vật lý người Anh Joseph John (JJ) Thomson phát hiện ra rằng nguyên tử không thể phân chia như đã tuyên bố trước đây. Ông đã tiến hành thí nghiệm sử dụng tia âm cực tạo ra trong một ống phóng điện và nhận thấy rằng các tia này bị hút bởi các tấm kim loại tích điện dương nhưng lại bị các tấm mang điện âm đẩy lùi. Từ đó suy ra các tia phải mang điện tích âm.
Bằng cách đo điện tích của các hạt trong tia, ông có thể suy ra rằng chúng nhẹ hơn hai nghìn lần so với hydro, và bằng cách thay đổi kim loại làm cực âm, ông có thể biết rằng các hạt này có mặt trong nhiều loại nguyên tử. Ông đã phát hiện ra electron (mặc dù ông gọi nó là ‘corpuscle’), và chỉ ra rằng nguyên tử không thể phân chia được, mà có những phần cấu thành nhỏ hơn. Khám phá này đã giúp ông giành được giải thưởng Nobel vào năm 1906.
Năm 1904, ông đưa ra mô hình nguyên tử dựa trên những phát hiện của mình. Được mệnh danh là ‘Mô hình bánh pudding mận’ (mặc dù không phải của chính Thomson), nó hình dung nguyên tử như một quả cầu mang điện tích dương, với các electron rải rác khắp nơi giống như quả mận trong một chiếc bánh pudding.
Các nhà khoa học đã bắt đầu nghiên cứu các phần tử bên trong của nguyên tử, nhưng mô hình của Thomson sẽ không tồn tại được lâu – và chính một trong những sinh viên của ông đã cung cấp bằng chứng để đưa nó vào lịch sử.
Ernest Rutherford là một nhà vật lý đến từ New Zealand, từng học tại Đại học Cambridge dưới thời Thomson. Công việc sau này của ông tại Đại học Manchester sẽ cung cấp những hiểu biết sâu hơn về bên trong của một nguyên tử. Công trình này được đưa ra sau khi ông đã nhận được giải thưởng Nobel năm 1908 cho những nghiên cứu của ông về hóa học các chất phóng xạ.
Rutherford đã nghĩ ra một thí nghiệm để thăm dò cấu trúc nguyên tử liên quan đến việc bắn các hạt alpha mang điện tích dương vào một tấm lá vàng mỏng. Các hạt alpha rất nhỏ nên chúng có thể xuyên qua lá vàng, và theo mô hình của Thomson cho thấy điện tích dương khuếch tán trên toàn bộ nguyên tử, nên làm như vậy ít hoặc không bị lệch. Bằng cách thực hiện thí nghiệm này, anh ấy hy vọng có thể xác nhận mô hình của Thomson, nhưng cuối cùng ông ấy lại làm điều hoàn toàn ngược lại.
Trong quá trình thí nghiệm, hầu hết các hạt alpha đã đi qua lớp giấy bạc mà ít hoặc không bị lệch hướng. Tuy nhiên, một số lượng rất nhỏ các hạt đã bị lệch khỏi đường đi ban đầu của chúng ở góc rất lớn. Điều này hoàn toàn bất ngờ; như chính Rutherford đã quan sát, “Điều đó thật khó tin khi bạn bắn một quả đạn pháo 15 inch vào một mảnh giấy lụa và nó quay trở lại và đánh bạn”.
Lời giải thích duy nhất có thể là điện tích dương không lan truyền khắp nguyên tử, mà tập trung ở một trung tâm nhỏ, dày đặc gọi là hạt nhân. Phần lớn phần còn lại của nguyên tử chỉ đơn giản là không gian trống.
Việc Rutherford phát hiện ra hạt nhân có nghĩa là mô hình nguyên tử cần được xem xét lại. Ông đề xuất một mô hình trong đó các electron quay quanh hạt nhân mang điện tích dương. Mặc dù đây là một cải tiến trên mô hình của Thomson, nhưng nó không giải thích được điều gì đã giữ cho các electron quay xung quanh thay vì chỉ đơn giản là xoắn vào hạt nhân.
Sau đó Niels Bohr. Bohr, một nhà vật lý người Đan Mạch, người đã tìm cách giải quyết các vấn đề bằng mô hình của Rutherford. Ông nhận ra rằng vật lý cổ điển không thể giải thích đúng những gì đang diễn ra ở cấp độ nguyên tử; thay vào đó, ông viện dẫn lý thuyết lượng tử để thử và giải thích sự sắp xếp của các electron. Mô hình của ông đã công nhận sự tồn tại của các mức năng lượng hoặc lớp vỏ của các electron.
Các điện tử chỉ có thể được tìm thấy trong các mức năng lượng cụ thể này; nói cách khác, năng lượng của chúng đã được định lượng và không thể nhận bất kỳ giá trị nào. Các electron có thể di chuyển giữa các mức năng lượng này (được Bohr gọi là ‘trạng thái tĩnh’), nhưng phải làm như vậy bằng cách hấp thụ hoặc phát ra năng lượng.
Đề xuất của Bohr về các mức năng lượng ổn định đã giải quyết được vấn đề của các electron đi vào hạt nhân ở một mức độ nào đó, nhưng không hoàn toàn. Những lý do chính xác phức tạp hơn một chút so với những gì chúng ta sẽ thảo luận ở đây, bởi vì chúng ta đang bước vào thế giới phức tạp của cơ học lượng tử; và như chính Bohr đã nói, “Nếu cơ học lượng tử không gây sốc sâu sắc cho bạn, thì bạn vẫn chưa hiểu nó”. Nói cách khác, nó trở nên kỳ lạ.
Hạn chế mô hình
Mô hình của Bohr không giải quyết được tất cả các vấn đề về mô hình nguyên tử. Nó hoạt động tốt đối với các nguyên tử hydro, nhưng không thể giải thích các quan sát về các nguyên tố nặng hơn. Nó cũng vi phạm nguyên lý bất định Heisenberg, một trong những nền tảng của cơ học lượng tử, nói rằng chúng ta không thể biết cả vị trí và động lượng chính xác của một electron.
Tuy nhiên, nguyên tắc này đã không được công nhận cho đến vài năm sau khi Bohr đề xuất mô hình của mình. Bất chấp tất cả những điều này, Bohr có lẽ vẫn là mô hình nguyên tử mà bạn quen thuộc nhất, vì nó thường là mô hình được giới thiệu lần đầu tiên trong các khóa học hóa học ở trường trung học hoặc trung học cơ sở. Nó vẫn có những công dụng của nó; nó khá hữu ích để giải thích liên kết hóa học và khả năng phản ứng của một số nhóm nguyên tố ở mức độ đơn giản.
Ở bất kỳ mức độ nào, mô hình vẫn yêu cầu tinh chỉnh. Tại thời điểm này, nhiều nhà khoa học đang nghiên cứu và cố gắng phát triển mô hình lượng tử của nguyên tử. Đứng đầu trong số này là nhà vật lý người Áo Erwin Schrödinger, người mà bạn có thể đã nghe nói đến trước đây (ông ấy là anh chàng với con mèo và chiếc hộp).
Năm 1926, Schrödinger đề xuất rằng, thay vì các electron chuyển động trong các quỹ đạo cố định hoặc các lớp vỏ, các electron hoạt động như sóng. Điều này có vẻ hơi kỳ lạ, nhưng bạn có thể đã nhớ lại rằng ánh sáng có thể hoạt động như cả sóng và hạt (cái được gọi là lưỡng tính sóng-hạt), và hóa ra các electron cũng có thể.
Schrödinger đã giải một loạt các phương trình toán học để đưa ra một mô hình cho sự phân bố của các electron trong một nguyên tử. Mô hình của ông cho thấy hạt nhân bao quanh bởi các đám mây mật độ electron. Những đám mây này là những đám mây xác suất; mặc dù chúng ta không biết chính xác vị trí của các electron, chúng ta biết chúng có khả năng được tìm thấy trong các vùng không gian nhất định.
Các vùng không gian này được gọi là các obitan electron. Có lẽ có thể hiểu được tại sao các bài học hóa học ở trường trung học không đi thẳng vào mô hình này, mặc dù đây là mô hình được chấp nhận ngày nay, bởi vì bạn sẽ mất thêm một chút thời gian để tìm hiểu!
Schrödinger không phải là từ cuối cùng trên nguyên tử. Năm 1932, nhà vật lý người Anh James Chadwick (một học sinh của Ernest Rutherford) đã phát hiện ra sự tồn tại của neutron, hoàn thành bức tranh của chúng ta về các hạt hạ nguyên tử tạo nên một nguyên tử.
Câu chuyện cũng không kết thúc ở đó; Các nhà vật lý kể từ đó đã phát hiện ra rằng các proton và neutron tạo nên hạt nhân tự phân chia thành các hạt gọi là quark – nhưng điều đó nằm ngoài phạm vi của bài đăng này! Ở bất kỳ mức độ nào, nguyên tử cho chúng ta một ví dụ tuyệt vời về cách các mô hình khoa học có thể thay đổi theo thời gian và cho thấy bằng chứng mới có thể dẫn đến các mô hình mới như thế nào.
Bài viết đến đây là hết rồi. Hi vọng sẽ giúp ích cho các bạn phần nào trong tương lai. Lần sau nếu có ai hỏi về chủ đề này thì hãy nhớ về hóa học đằng sau chúng nhé!
Tham khảo Compound Interest, Thoughtco và Sisd.

