Vitamin C là một trong những loại vitamin thiết yếu cần thiết cho cơ thể để chống chọi lại bệnh tật.
Vì thế việc hiểu rõ về nó là điều hết sức quan trọng đặc biệt trong lĩnh vực hóa học. Trong bài viết lần này, chúng ta sẽ tìm hiểu về hóa học của vitamin C nhé!
Đôi nét
Chỉ vài thế kỷ trước, những người đi biển châu Âu (và có thể là nhiều người khác) đã chết trong những chuyến đi biển dài hàng tháng đến phương Đông.
Các chuyến đi đến phương Đông là điều cần thiết đối với các thương nhân châu Âu để có được những loại gia vị, vải vóc và các mặt hàng buôn bán khác được yêu thích, đã từng mất hàng tháng trời.
Và như bạn có thể hình dung, họ không có nguồn cung cấp thực phẩm tươi nhất trên tàu.
Họ sẽ không nhất thiết phải dùng hết calo, họ đã ăn hết những loại trái cây và rau quả vô cùng quan trọng.
Do đó, lý do của nhiều ca tử vong này không phải là do thiếu carbohydrate, protein, v.v. Không, đó là do thiếu vitamin C (axit ascorbic). Bạn có thể đã nghe nói về căn bệnh này trước đây: bệnh scurvy.
Scurvy (hay scorbut) là một căn bệnh gây ra do thiếu vitamin C (axit ascorbic).
Theo Wikipedia.
Thật không may, căn bệnh và cách chữa trị của nó, đã được phát hiện nhiều lần nhưng bị lãng quên giữa chừng, trước khi có thể ngăn ngừa đúng cách.
Và đến nay, bệnh scurvy không hoàn toàn biến mất trên thế giới, điều này cho thấy việc bổ sung đủ vitamin C quan trọng như thế nào đối với cơ thể chúng ta.
Vấn đề phức tạp hơn: cơ thể chúng ta không thể tự tạo ra vitamin C và vitamin C không ổn định. Nó dễ bị mất đi khi để ly nước cam của bạn quá lâu, đặc biệt là trong quá trình chế biến thức ăn.
Thủ phạm chính là do quá trình oxy hóa vitamin C. May mắn thay, một khi bạn hiểu điều này xảy ra như thế nào, bạn sẽ có cách để ngăn chặn nó.
Tham khảo thêm về những thông tin thú vị về axit ascorbic tại đây.
Hóa học đằng sau
Vitamin C là axit ascorbic
Khi đọc về vitamin C, bạn có thể bắt gặp cái tên axit ascorbic. Axit ascorbic là vitamin C, nó chỉ là tên hóa học. Như tên đã nói, vitamin C là một loại axit.
Điều này có nghĩa là nếu bạn thêm axit ascorbic vào nước, nó sẽ làm nước hơi chua, giá trị pH sẽ giảm xuống dưới 7. Nó làm như vậy (cũng như bất kỳ axit nào) bằng cách tăng nồng độ proton (H+) trong nước.
Công thức hóa học của vitamin C là C6H8O6. Trong công thức cấu tạo dưới đây, bạn có thể thấy các nguyên tử trong phân tử được kết nối với nhau như thế nào.
Lưu ý vòng trong cấu trúc. Vòng này thực sự rất quan trọng đối với hoạt động và tính chất của vitamin C.
Vòng như vậy phổ biến trong nhiều phân tử thực phẩm đặc biệt khác và đặc biệt tốt trong việc giữ các electron.
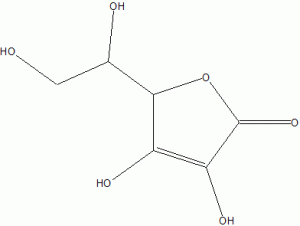
Axit ascorbic và ascorbate
Bạn có thể tìm công thức cho phản ứng axit từ axit ascorbic bên dưới. Điều quan trọng là phải biết rằng phản ứng này là thuận nghịch. Tức là nó có thể đi theo hai hướng.
Nó đi theo cách nào phụ thuộc vào các điều kiện bên ngoài. Nếu có nhiều proton (H+) trong hệ thống thì nhiều khả năng nó sẽ đi từ phải sang trái. Ngược lại nếu hầu như không có.
C6H8O6 (axit ascorbic)↔C6 H7O6– (ascorbate) + H+
Khi axit ascorbic đã cho đi / giải phóng proton của nó, tên của nó sẽ thay đổi thành ascorbate (-ion).
Ascorbate có thể tạo thành muối khi nó kết nối với các ion tích điện dương như natri (Na+) hoặc canxi (Ca2+).
Bạn thực sự có thể mua các muối ascorbate này từ nhiều nhà sản xuất khác nhau.
Trong cơ thể bạn cũng như trong nhiều hệ thống thực phẩm, dạng vitamin C phổ biến nhất là ascorbate, không phải axit ascorbic.
Quá trình oxy hóa axit ascorbic
Hãy nhớ cách nguyên tử được cấu tạo từ lõi gồm các proton, neutron với các electron ‘lơ lửng’ xung quanh? Trong hầu hết các phản ứng hóa học, các electron này được chuyển giữa các dạng.
Ascorbate không phải là một ion rất bền và có xu hướng cho đi các điện tử của nó trong các điều kiện thích hợp.
Chúng tôi gọi đây là một phản ứng oxy hóa, ascorbate bị oxy hóa, làm mất một số điện tử của nó. Phản ứng oxi hóa là một ví dụ về phản ứng oxi hóa khử.
Trong loại phản ứng này, các electron được chuyển từ dạng này sang loài khác. Điều này sẽ trông giống như:
C6H7O6– (ascorbate) ↔ C6H6O6 (axit dehydroascorbic) + 2e – + H+
Lưu ý một lần nữa rằng các mũi tên chỉ theo hai hướng. Nói cách khác, phản ứng có thể tiến hành theo cả hai cách. Nó phụ thuộc vào các điều kiện một lần nữa, mà trong hai điều kiện xảy ra.
Axit dehydroascorbic
Phân tử được hình thành do quá trình oxy hóa ascorbate là axit dehydroascorbic. Cả axit ascorbic và axit dehydroascorbic đều tham gia vào các chức năng quan trọng trong cơ thể.
Những phản ứng này cứ lặp đi lặp lại. Các electron được cho đi sẽ tham gia vào tất cả các loại phản ứng. Khả năng cho / nhận electron là một trong những chức năng chính của vitamin C trong cơ thể.
Vì cả axit dehydroascorbic và axit ascorbic đều có liên quan đến cơ thể con người, nói chung hàm lượng vitamin C tổng thể là tổng của hai loại này được cộng lại.
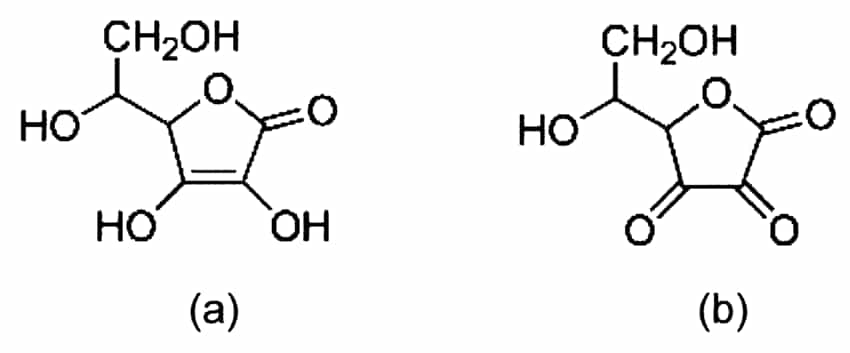
Tóm tắt phản ứng tổng thể
Nếu chúng ta bỏ đi giữa bước ascorbate (mà bạn thường thấy trong sách giáo khoa) thì phản ứng cân bằng tổng thể sẽ trở thành:
C6H8O6 (axit ascorbic)↔C6H6O6 (axit dehydroascorbic) + 2e – + 2H+
Nhìn chung, chúng ta có thể nói rằng: vitamin C có khả năng khử các phân tử khác (và do đó tự nó bị oxy hóa). Điều này có nghĩa là nó có thể tặng hai electron cho một thành phần khác.
Các phiên bản mở rộng hơn một chút của các phản ứng hóa học mà chúng tôi vừa mô tả liên quan đến một số gốc.
Chúng tôi sẽ không đi vào chi tiết về những thứ đó, nhưng nó có nghĩa là vitamin C là một chất chống oxy hóa. Nó ức chế quá trình oxy hóa của các phân tử khác không nên bị oxy hóa.
Điều này có thể hữu ích trong nhiều trường hợp khác nhau và đóng một vai trò rất quan trọng đối với cơ thể con người. Ngăn ngừa bệnh scurvy chỉ là một trong nhiều lý do mà vitamin C giúp ích cho cơ thể chúng ta.

Mất vitamin C
Miễn là axit ascorbic và axit dehydroascorbic tiếp tục phản ứng với nhau, không có vitamin C nào bị mất.
Tuy nhiên, axit dehydroascorbic có thể phản ứng thêm trong các phản ứng không thuận nghịch. Nếu điều đó xảy ra, bạn thực sự mất vitamin C.
Nói chung, các nhà sản xuất thực phẩm (và người tiêu dùng) không muốn vitamin C bị mất đi trước khi chúng ta có thể tiêu thụ và để nó hoạt động trong cơ thể chúng ta.
Do đó, các nhà khoa học thực phẩm đã nghiên cứu cách kiểm soát tốc độ oxy hóa vitamin C cũng như sự phân hủy của axit dehydroascorbic. Năm thông số có ảnh hưởng đã được tìm thấy:
- Oxy
- Những ion kim loại
- pH của nước trái cây
- Ánh sáng
- Nhiệt độ
1. Oxy và oxy hóa axit ascorbic
Quá trình oxy hóa axit ascorbic có thể bị làm chậm / ngăn chặn nếu không có chất oxy hóa. Nói cách khác, một phân tử phải có mặt sẽ nhận các electron.
Oxy được biết đến là một chất oxy hóa rất tốt. Trên thực tế, tên ‘chất oxy hóa’ có nguồn gốc từ oxy vì oxy là một trong những chất oxy hóa đầu tiên được phát hiện.
Khi để ngoài không khí có chứa oxy, axit ascorbic dễ bị oxy hóa. Do đó, nếu không có oxy, quá trình oxy hóa axit ascorbic sẽ diễn ra ít hơn. Có thể có chất oxy hóa khác, nhưng việc loại bỏ chất quan trọng này sẽ có tác động đáng kể.
Các nhà sản xuất giải quyết vấn đề này bằng cách khử khí trong nước trái cây. Bằng cách khử khí trong nước trái cây, hầu hết oxy sẽ rời khỏi nước ép.
Sau khi khử sục khí, càng ít không khí càng tốt sẽ còn lại trong chai. Do đó, chúng thường được lấp đầy ở mức cao.
Ở nhà, điều quan trọng là phải bảo quản nước cam trong chai đậy kín nếu không sử dụng hết trực tiếp. Điều này sẽ hạn chế lượng oxy đi vào nước trái cây và oxy hóa axit ascorbic.
2. Các ion kim loại và phản ứng khử
Các ion kim loại cũng tham gia tốt vào phản ứng oxi hóa và phản ứng ngược, khử của nó. Trong trường hợp axit ascorbic, các ion kim loại có thể xúc tác phản ứng.
Điều này có nghĩa là chúng không thực sự được sử dụng trong quá trình phản ứng, nhưng có thể dùng làm nơi lưu trữ tạm thời cho các electron.
Nếu có bất kỳ lời khuyên thiết thực nào từ việc này, tốt nhất bạn không nên đựng nước cam trong nồi đồng. Các ion đồng sẽ tăng tốc độ phản ứng lên rất nhiều.
3. pH ảnh hưởng lớn đến quá trình oxy hóa
Đối với nhiều phản ứng, pH ảnh hưởng đến tốc độ phản ứng. Đối với các phản ứng có thành phần axit hoặc kiềm, điều đó đặc biệt quan trọng.
Trong phản ứng oxy hóa của axit ascorbic mà chúng ta đã thảo luận ở trên, bạn có thể thấy rằng nó giải phóng cả proton (H+) và electron (e–).
Tuy nhiên, nếu axit ascorbic nằm trong một môi trường rất axit thì sẽ có rất nhiều proton xung quanh nó. Điều này có thể làm chậm phản ứng. Người ta nhận thấy rằng phản ứng diễn ra nhanh nhất ở pH = 4.
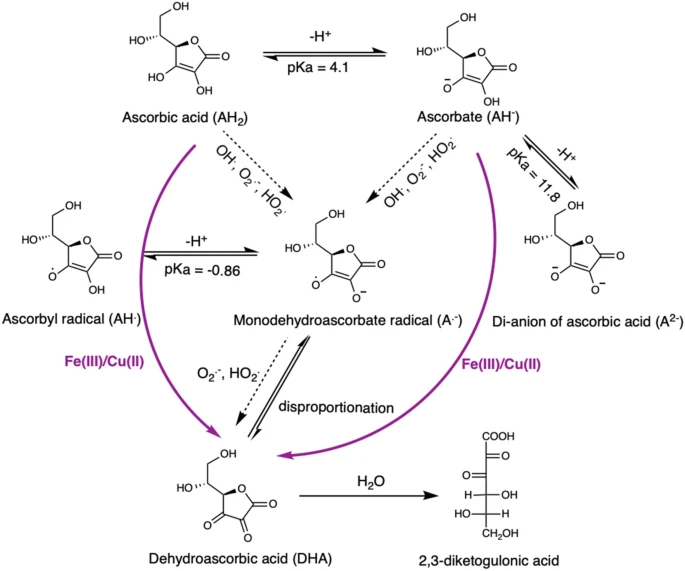
Ở độ pH cao hơn (do đó có tính kiềm hơn) hoặc thấp hơn (do đó có tính axit hơn), phản ứng sẽ diễn ra chậm hơn. Vì độ pH của một quả cam là khoảng 3-4, nước cam thực sự là một nơi khá tốt để phản ứng này xảy ra.
Miễn là quả cam còn nguyên thì sẽ không có phản ứng nào xảy ra, nó được bảo vệ khỏi oxy và ánh sáng và tất cả các tế bào vẫn còn nguyên vẹn. Nhưng một khi bạn bắt đầu ép và trộn, bữa tiệc bắt đầu!
4. Quá trình oxy hóa ánh sáng và vitamin C
Người ta biết rằng ánh sáng ảnh hưởng đến tốc độ oxy hóa vitamin C, như trường hợp oxy hóa dầu ô liu. Tốc độ oxy hóa của axit ascorbic tăng lên khi sự chiếu sáng của ánh sáng tăng lên ( Mapson, 1962 ).
Do đó, những chai màu xanh lá cây dành cho dầu ô liu và những gói nước cam bảo quản lâu dài thường không thể vận chuyển được.
Ảnh hưởng chính xác của ánh sáng rất phức tạp. Tôi vẫn chưa biết cơ chế chính xác. Tuy nhiên, lời khuyên chung là để nước cam ở nơi tối.
5. Nhiệt độ và tốc độ phản ứng
Nhiệt độ quyết định sự chuyển động của các phân tử trong thực phẩm. Nhiệt độ càng cao thì càng có nhiều nguyên tử và phân tử chuyển động xung quanh. Điều này làm cho các phân tử có nhiều khả năng gặp nhau hơn và do đó phản ứng.
Do đó, nhiệt độ cao hơn thường dẫn đến tốc độ phản ứng cao hơn. Đây cũng là trường hợp của quá trình oxy hóa vitamin C, như đã được các nhà nghiên cứu nghiên cứu trong nước ép dâu tây.
Phản ứng Maillard của vitamin C
Một khi vitamin C đã bị oxy hóa, nó có thể phản ứng thêm thành nhiều con đường khác nhau. Một trong số đó là phản ứng Maillard.
Phản ứng Maillard gây ra màu nâu của nhiều sản phẩm thực phẩm thông qua một loạt các phản ứng rất phức tạp.
Bên cạnh phản ứng Maillard, có rất nhiều cách khác nhau để axit dehydroascorbic có thể phản ứng thêm. Nhưng hiện tại, chúng ta sẽ không thảo luận chi tiết về những điều đó, sẽ có quá nhiều.
Ngoài ra, cố gắng ngăn chặn quá trình oxy hóa axit ascorbic có lẽ là một cách tốt hơn là ngăn chặn các phản ứng khác này. Axit dehydroascorbic đơn giản là kém ổn định hơn và rất có thể khó kiểm soát hơn.
Bài học kinh nghiệm? Nếu bạn không muốn bị bệnh scorbut, xin vui lòng không bảo quản nước cam của bạn trong một chảo đồng, nơi nóng, nhiều oxy dưới ánh sáng mặt trời.
Bạn chỉ cần vắt cam và uống trong ngày. Nghĩ xem bạn muốn ép hay trộn …
Bài viết đến đây là hết rồi. Hi vọng sẽ giúp ích cho các bạn phần nào trong tương lai. Lần sau nếu có ai hỏi về chủ đề này thì hãy nhớ về hóa học đằng sau chúng nhé!
Tham khảo Foodcrumbles.
